Общие тенденции:
Традиционными методами лечения опухолей являются хирургические операции, системная химиотерапия, лучевая терапия. Научный прогресс в медицине приводит к тому, что на «первый план» выходят менее инвазивные методы лечения, при этом общая эффективность терапии чаще даже возрастает, или остается на прежнем уровне, однако мы все же получаем преимущество в виде укороченного периода реабилитации после лечения, снижения количества койко-дней, снижения общей токсичности и прочего. Продолжают развиваться лапароскопические вмешательства и различные малоинвазивные технологии.
Развитие этой техники и технологий стало заметно нарастать с 90-х годов прошлого века. Обычная хирургическая операция имеет, как правило, достаточно высокий уровень осложнений, смертности, вызывают различного рода нарушение иммунитета. После операции бывает достаточно продолжительные восстановительный период и боль. Лапароскопические хирургические вмешательства более комфортны для пациентов, однако длятся дольше. Период восстановления после операции минимальный. Следует отметить, что операционные осложнения после лапароскопических операций, хотя встречаются реже, однако в общем сопоставимы с таковыми при обычных хирургических операциях.
Другой вид малоинвазивных вмешательств, для разрушения (абляции) опухолей использует различные виды энергии. Это:
- радиочастотная абляция, когда для разрушения опухоли используют специальные электроды;
- микроволновая абляция, в ходе которой энергия подводится к опухоли с помощью специальных «антенн»;
- лазерная абляция, энергия подводится с помощью светопроводящих волокон;
- криоабляция, при которой к опухоли подается жидкий азот с температурой минус 196 градусов по Цельсию. Азот подается с помощью специальной иглы с изоляцией;
- ультразвуковая абляция HIFU, при этой процедуре создается пучок концентрированного ультразвука, который проникает через кожу и ткани к опухоли и разрушает ее. При этом нет необходимости введения специальных проводников в тело пациента. Процедура абсолютно дистанционна.
Отдельно можно выделить методы химического разрушения опухолей, когда для лечения используются этиловый спирт, уксусная кислота и другие агенты.
Также несколько особняком стоят методы химиоэмболизации и внутриартериальные инфузии химиопрепаратов.
HIFU
Впервые высокоэнергетический фокусированный ультразвук (High Intensive Focused Ultrasound- HIFU) был использован для разрушения опухолей в 1940 году. Однако первые промышленные установки появились в 1997 году, и с этого момента данная методика стала успешно развиваться.
HIFU является действительно неинвазивным методом. Отсутствует риск распространения опухолевой ткани и имплантации опухолевых клеток по ходу иглы, что имеет место, например, при алкоголизации или радиочастотной абляции. Практически нет риска получить кровотечение. Фокусированный ультразвук высокой энергии беспрепятственно проходит через кожу и подлежащие ткани, не повреждая их, к опухоли. Только при фокусировке в очаге концентрация энергии достигает такого уровня, что возможна немедленная гибель клеток опухоли. Механизм HIFU-воздействия не является опухолеспецифичным, поэтому возможно лечить различные виды опухолей. В отличие от методов Лучевой Терапии, где существует предельно допустимая доза лучевой нагрузки на ткань после которой добавление доз лучевой терапии более невозможно, HIFU может проводиться неоднократно, и нет возможности "перелечить" опухоль. Осложнения при этом методе очень редки, а серьезные осложнения почти не встречаются. HIFU может применяться и с паллиативной целью, как циторедуктивная методика для уменьшения опухолевой симптоматики у пациентов с плохим прогнозом.
Как же происходит лечение с помощью HIFU.
Термин "ультразвук" относится к механической волне с частотой выше частоты, воспринимаемой человеческим ухом (16 kHz). Медицинский ультразвук получается при изменении напряжения пъезоэлектрического материала, например цирконата титана. Этот материал осциллирует в такт подводимому электрическому току. Ультразвуковая волна проходит сквозь ткани, вызывая циклические перепады повышенного и пониженного давления (компрессия и разрежение). Большинство врачей знакомы с диагностическим ультразвуком, использующим частоты от 1 до 20 MГц. В лечебном ультразвуке используются частоты 0,8-3,5 МГц, при этом энергетический уровень ультразвуковой волны на несколько порядков выше, чем при стандартном диагностическом ультразвуковом исследовании. По аналогии со световыми лучами, ультразвуковые лучи могут фокусироваться в точке. Энергия высокого уровня, переносимая HIFU может быть увеличена еще в большей степени и доставлена с точностью к маленькому объему, сохраняя интактными окружающие ткани.
Отличие HIFU от других минимально инвазивных энергетических видов разрушения опухолей
Радиочастотная аблация (РЧА)
Электрический ток высокой частоты подводится к очагу через игольчатые электроды. На кончике электрода электрическая энергия превращается в тепловую, приводя к прямому повреждению клетки и их гибели. На кончик электрода подается физраствор для того, чтобы не допускать высушивания тканей, поэтому не могут быть пролечены опухоли больших объемов. РЧА проводится чрескожно, лапароскопически, во время открытого хирургического вмешательства. Основной областью применения является лечение опухолей печени и почек диаметром менее 4х см, хотя есть работы об успешной РЧА метастаза колоректального рака диаметром 7 см.
Криоаблация
При криоаблации происходит два или три цикла замораживания, что приводит к повреждению тканей. Один или более криодатчиков вводятся непосредственно в очаг, обычно под контролем ультразвука. В датчиках в фазу охлаждения начинает циркулировать жидкий азот или аргон. В течение 15 минут происходит образование шарика льда и его формирование можно наблюдать непосредственно с помощью ультразвука. Внутриклеточное и внеклеточное формирование льда приводит к осмотически индуцированным изменениям PH и денатурации белков, прямому повреждению мембран. Отсроченная гибель клеток может происходить в результате сосудистого тромбоза и усиления сосудистой проницаемости. Таким образом, пролечивались опухоли печени , почки и простаты. Так же как и РЧА, криотерапия может проводится лапароскопически, чрескожно, через лапаротомный доступ.
Лазерная аблация
Интерстициальная лазерная термотерапия, известная также под названием лазер-индуцированная термотерапия, применяется начиная с 1980 –х годов. Иглы устанавливаются чрескожно под ультразвуковым или МРТ – наведением, после чего вводятся лазерные волоконные структуры.
HIFU абляция
Объем HIFU - аблации после единичного выстрела (очаг поражения) весьма мал, его форма и размеры варьируют в зависимости от формы излучателя. Обычно очаг вытянутой сигарообразной формы и имеет размеры 1-3 мм (в поперечнике) х 8-15 мм (по длинной оси) (см рисунок). Для аблации клинически значимых опухолей необходимо сделать множество выстрелов, расположив очаги поражения рядом, систематически "зарисовывая" срезы опухоли перекрыть очагами поражения всю опухоль.
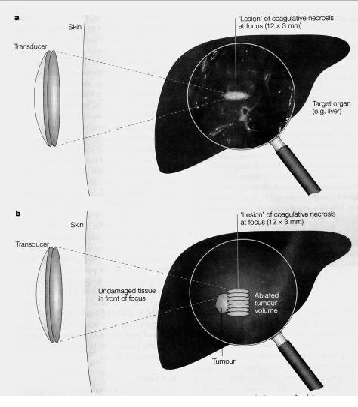
Специалисты выделяют три основных механизма повреждающего действия HIFU.
Первый – это термическая абляция, основной механизм действия. Высокоэнергетический ультразвук может проникать через ткани, не разрушая их, однако при его фокусировке с помощью линз в определенной зоне организма возникает моментальное повышение температуры до 90 градусов по Цельсию, что вызывает коагуляционный некроз. При этом окружающие ткани остаются нетронутыми.
Второй механизм - это акустическая кавитация. Ультразвук вызывает микровибрацию в тканях, при этом молекулярные структуры многократно сжимаются и расширяются. Газ, находящийся в тканях в жидком состоянии, переходит в газообразное и превращается в микропузырьки, которые при достижении ультразвуковой волны резонансной частоты лопаются, и давление в этой зоне возрастает многократно, а температура колеблется в пределах 2000-5000 градусов по Цельсию, что и вызывает гибель ткани. Развитие кавитации вызывается при определенных условиях длины импульса, его частоты и интенсивности, что и учитывается при лечении.
Третий механизм- это прямое повреждение сосудов, питающих опухоль.
Таким образом суммарный биологический эффект этих трех механизмов вызывает коагуляционный некроз и гибель опухоли.
Согласно проведенным исследованиям, граница между зоной некроза и здоровой тканью составляет всего несколько клеток. Зона разрушения включает в себя саму опухоль и небольшую зону по периферии из нормальной ткани. Примерно через 2 недели разрушенная ткань замещается фиброзной тканью. В исследованиях было показано, что действие HIFU не способствует опухолевой диссеминации и не увеличивает риск метастазирования.
Внешний вид аппарата HIFU:
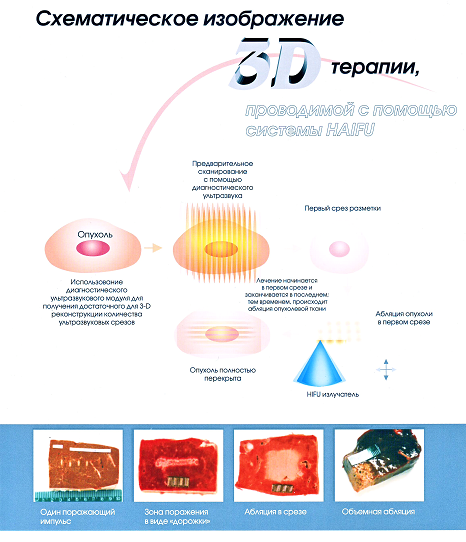
Проиллюстрируем систему трехмерного лечения на аппарате HIFU. Морфологически в бычьей печени in vitro определяется коагуляционный некроз: точечный фокус поражения в результате воздействия единичного импульса, фокальные изменения в виде «дорожки», некроз в целом срезе в результате последовательного его покрытия фокальными очагами в виде «дорожек», объемный некроз в результате воздействия импульсов по всей площади среза по каждому срезу (слою) опухоли.
Показания к применению HIFU:
- Рак молочной железы;
- Злокачественная опухоль костной ткани;
- Рак печени;
- Саркома мягких тканей;
- Рак почки;
- Рак мочевого пузыря;
- Опухоли малого таза;
- Забрюшинные опухоли;
- Рак поджелудочной железы;
- Метастазы опухоли;
- Паллиативное лечение распространенных опухолевых процессов;
- Рецидив солидной опухоли после традиционного хирургического вмешательства;
- Остаточная опухоль после неудачного хирургического вмешательства, в тех случаях, когда повторная операция не показана;
- Опухоли поверхностных тканей;
- Фиброма матки;
- Доброкачественные опухоли молочных желез;
- Доброкачественные опухоли мягких тканей
Противопоказания:
- Опухоли полых органов и газосодержащих органов, например: легких, желудка, кишки;
- Опухоли средостения;
- Спинальные опухоли
Вопросы безопасности
Одним из самых важных вопросов при планировании лечения пациенту остается вопрос о том, не ухудшится ли клинический исход заболевания в результате применения данного вида лечения. Многочисленные исследования в эксперименте на животных и клинические исследования больных подтвердили, что в процессе использования HIFU не происходит диссеминация опухолевого процесса и не увеличивается частота метастазирования по сравнению со стандартными методами лечения. Другим важным вопросом является вопрос безопасности и побочных эффектов. Среди побочных эффектов, которые описаны различными авторами, наиболее частым является умеренная боль в зоне абляции. В некоторых случаях описывают ожоги, транзиторную лихорадку, описана также возможность повреждения стенки прямой кишки при трансректальном использовании HIFU в лечении рака предстательной железы. В среднем частота осложнений не превышает 1-2%.
Клиническое применение
Первым клиническим опытом применения HIFU в онкологии был опыт лечения рака предстательной железы. К настоящему времени с помощью HIFU во всем мире пролечены уже не одна тысяча пациентов и показания к применению значительно расширились и продолжают расширяться.
С 90-х годов прошлого века предложено несколько типов устройств для HIFU-абляции. Практические применение нашли два типа, которые различаются по способу визуализации и наведения. В одной системе используется МРТ-наведение, в другой ультразвук в В-режиме.
Клинические примеры
1. Лечение рака печени с помощью HIFU.
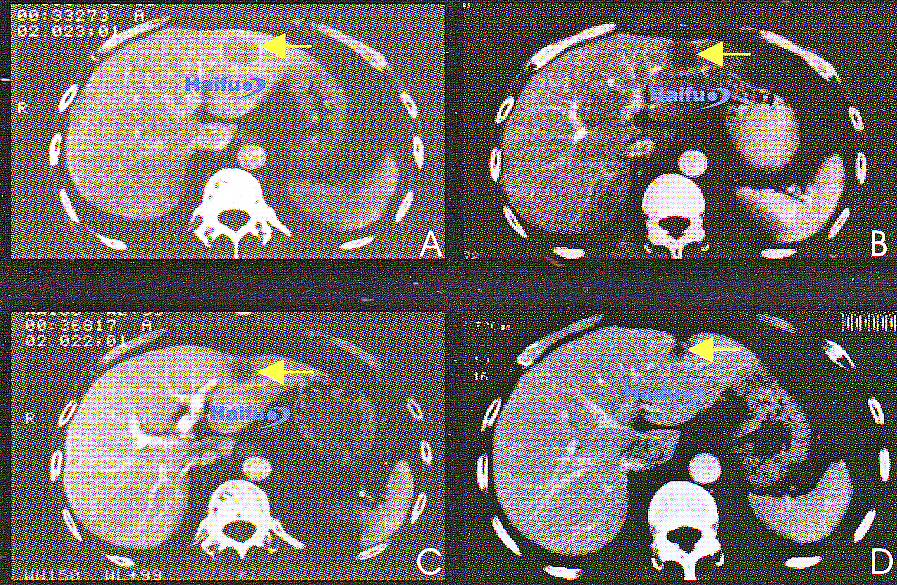
КТ-срезы с контрастированием 49-летнего пациента с гепатокарциномой, которому однократно проводился сеанс HIFU.
A) Перед лечением: визуализируется опухоль в левой доле печени (указана стрелкой) диаметром 4 см;
B) Через 3 месяца после HIFU; в опухоли отсутствует накопление контраста (стрелка);
C) Через 12 месяцев после HIFU; наблюдается уменьшение размеров опухоли, опухолевая ткань не контрастируется (стрелка);
D) Через 24 месяца после HIFU; отмечается прогрессивное уменьшение размеров опухоли (стрелка).
2. КТ-срезы с контрастированием 56-летнего пациента с гепатокарциномой в поздней стадии после однократного сеанса HIFU.
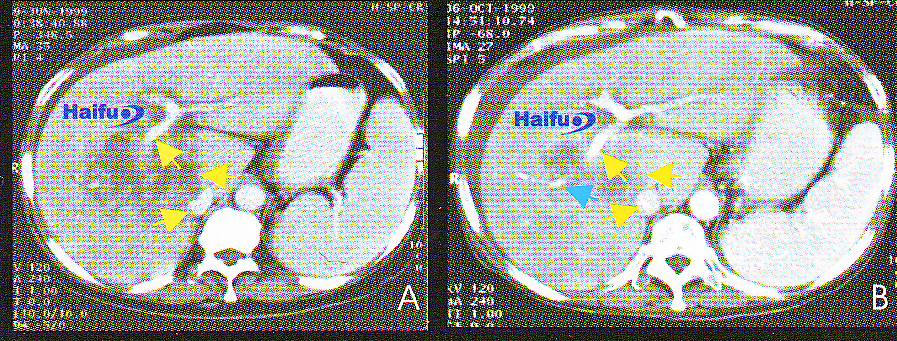
А) Перед HIFU пациенту проводилось три процедуры транскатетерной артериальной эмболизации, однако добиться контроля опухолевой прогрессии не удалось. Диаметр гепатокарциномы составлял 12 см. Опухоль инвазирует правую ветвь воротной вены (желтая стрелка), нижняя полая вена сдавлена (желтая стрелка), В брюшной полости определяется небольшое количество асцитической жидкости.
В) Четыре месяца после HIFU; отмечается регрессия опухоли (желтая стрелка), декомпрессия опухоли (желтая стрелка). В дистальном отделе воротной вены регистрируется кровоток (голубая стрелка), что означает реканализацию воротной вены.
3. МРТ-сканы с контрастным усилением гандолинием 62-летнего пациента с гепатокарциномой, леченного однократно HIFU и трансартериальной химиоэмболизацией.
А) До лечения. Опухоль имеет диаметр 11 см, локализуется в правой доле печени. Опухоль хорошо накапливает контрастное вещество, определяется высокий уровень перфузии опухолевой ткани (стрелки).
В) Через 4 недели после трансартериальной химиоэмболизации. Перфузия опухоли уменьшилась, но не исчезла (стрелки).
С) Через 2 недели после HIFU. Опухоль не накапливает контраст (стрелки).
4. МРТ-сканы с контрастным усилением гандолинием пациента с двумя узлами гепатокарциномы, которому проводилось однократное лечение
HIFU. Одна опухоль располагалась под диафрагмой, другая рядом с нижней полой веной.

А1, А2) До HIFU. В правой доле печени визуализируется два образования (стрелки).
В1, В2) Через 2 недели после процедуры HIFU. Отсутствие накопления контраста подтверждает наличие коагуляционного некроза в обеих узлах опухоли (стрелки).
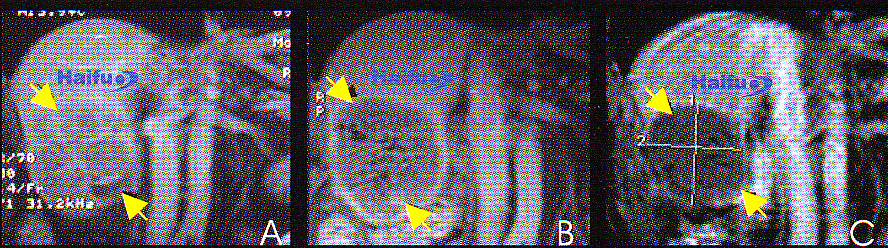
5. МРТ-сканы с контрастированием гандолинием (Т1-ви) 36-летней пациентки с раком молочной железы:

Аксиальные (А1) и сагиттальные (В1) срезы пораженной железы до HIFU.
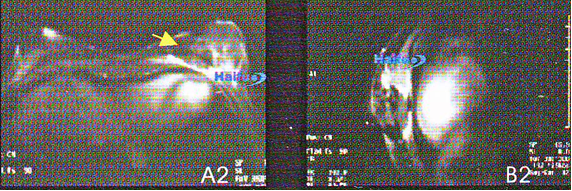
Соответствующие срезы (А2 и В2), через неделю после сеанса HIFU. После лечения накопление контрастного вещества в опухоли не происходит (стрелка).
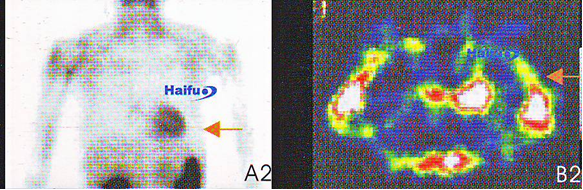
6. Остеосцинтиграммы с Tc-99m (А) и ПЭТ-КТ (В) 62-летней пациентки с раком молочной железы:
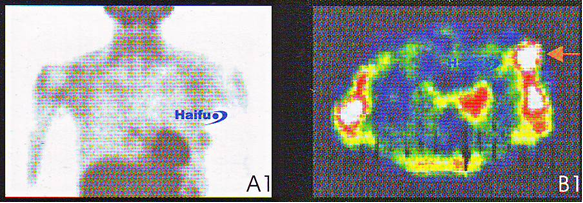
на А1 и В1 изображениях определяется зона повышенного накопления, соответствующая опухолевому узлу.
Соответствующие срезы (А2 и В2), через неделю после сеанса HIFU. После лечения накопление контрастного вещества в опухоли не происходит (стрелка).
6. Остеосцинтиграммы с Tc-99m (А) и ПЭТ-КТ (В) 62-летней пациентки с раком молочной железы:

на А1 и В1 изображениях определяется зона повышенного накопления, соответствующая опухолевому узлу.

На изображениях А2 и В2, выполненных через неделю после сеанса HIFU накопление в опухоли отсутствует (стрелка).
7. Дигитальная субтракционная ангиография 22-летнего пациента после единственного сеанса HIFU по поводу остеосаркомы дистального отдела бедра.
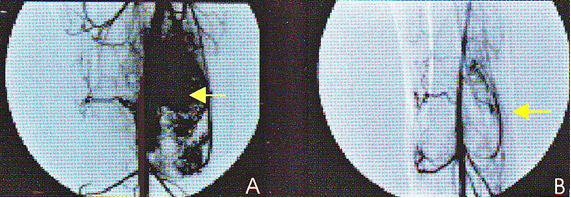
А) до HIFU на ангиограмме отчетливо визуализируется капиллярная сеть опухоли (стрелка). Через 3 месяца после HIFU капиллярная сеть на изображении отсутствует, что подтверждает абляцию опухоли (стрелка).
8. Компьютерная томография у 20-летнего пациента, леченного с помощью HIFU по поводу остеосаркомы дистальной трети бедра.
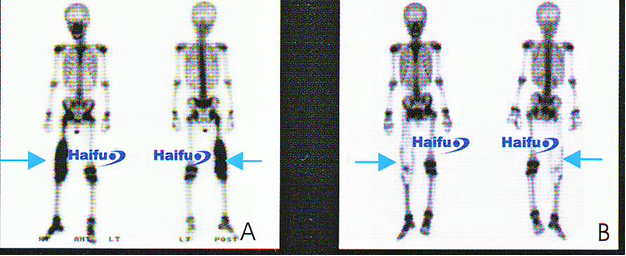
На А1, 2 изображениях до сеанса HIFU в мягких тканях бедра визуализируется опухоль (стрелка), определяется разрушение кортикального слоя кости опухолевой тканью (стрелка). В1 и 2 изображения получены через 5 лет после HIFU. Определяется исчезновение опухоли мягких тканей и восстановление кортикального слоя кости (стрелка).
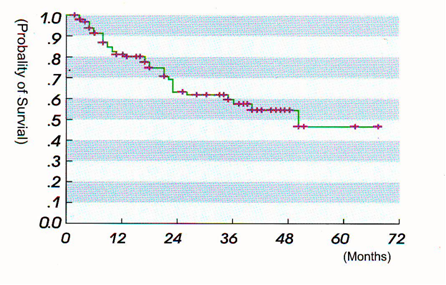
Кривая выживаемости Каплана-Мейера в группе из 96 пациентов с первичными опухолями костей, леченных HIFU. (получены результаты – 6-летняя выживаемость около 46%).
9. МРТ с контрастированием гандолинием 71-летнего пациента с мягкотканой саркомой бедра.
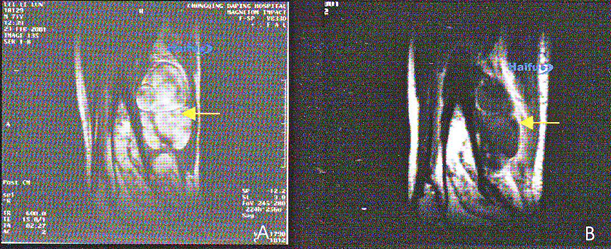
А) Сагиттальный срез до HIFU. В опухоли отчетливо визуализируется интенсивное накопление контрастного вещества (стрелка). В) через 2 недели после HIFU. В пролеченной зоне контрастное вещество не накапливается (стрелка), что означает наличие коагуляционного некроза ткани опухоли.
10. КТ с контрастированием 78 летнего пациента с местно-распространенным раком поджелудочной железы.
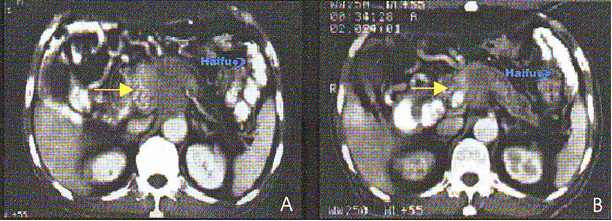
А) До HIFU в аксиальных срезах визуализируется крупная злокачественная опухоль поджелудочной железы (стрелка). В) Через 9 месяцев после HIFU. Отмечается регрессия пролеченной опухоли (стрелка).
11. МРТ в Т1ви с контрастированием гандолинием 41-летней пациентки с фибромой матки.
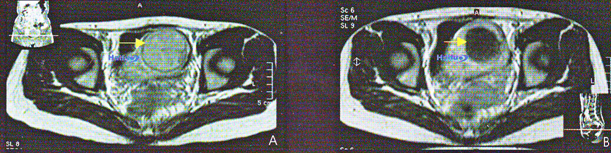
А) До HUFU. В аксиальном срезе внутри фибромиомы определяется контрастное усиление (стрелка). В) Через 4 недели после HIFU, в том же срезе в пролеченной зоне уже не определяется накопление контрастного вещества (стрелка), что означает развитие коагуляционного некроза.
12. МРТ (Т1 ви) с контрастным усилением гандолинием у 66-летнего пациента с почечным раком единственной почки.
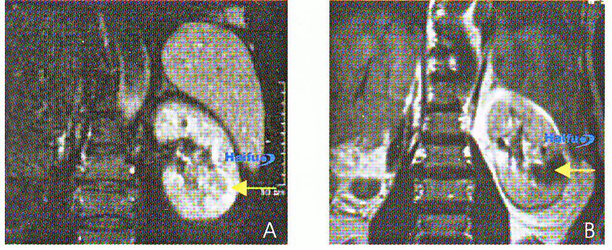
А) Коронарный срез до проведения HIFU. В опухоли определяется контрастное усиление (стрелка). В) Через 2 недели после HIFU. Накопление контрастного препарата в опухоли не определяется (коагуляционный некроз) (стрелка).














