Диссеминированный рак пищевода
Приблизительно 8 из 10 пациентов на момент первичной госпитализации для проведения специального лечения по поводу рака пищевода являются неоперабельными в силу распространения опухолевого процесса, наличия отдаленных метастазов, серьезных сопутствующих заболеваний или ослабленного состояния, обусловленного стенозирующим характером роста опухоли, приводящего к дисфагии и, как следствие, нарушениям белкового, жирового, углеводного и водно-электролитного обмена.
Пациентам с метастатическим раком пищевода проводятся различные варианты симптоматической специальной терапии в зависимости от конкретной клинической ситуации.
Тяжесть ситуации в большей степени определяется тем, имеется ли сочетание первичной опухоли ( или рецидива) и отдаленных метастазов.
При наличии первичной опухоли ( рецидива), ведущая симптоматика, как правило, представляет проблемы с прохождением пищи по пищеводу. При наличии только отдаленных метастазов чаще наблюдаются различные варианты опухолевой интоксикации и нарушения функций того органа, где локализуются метастазы.
Перед тем, как проводить специальное лечение, чаще всего необходимо осуществить коррекцию нарушения прохождения пищи по пищеводу (при наличии первичной опухоли или рецидива в зоне анастомоза). Для этих целей используется стентирование или брахитерапия. Брахитерапия фракция 12 Гр, является наиболее оптимальным вариантом коррекции дисфагии, так как обеспечивает лучший контроль симптомов при меньшей частоте осложнений.
Одним из перспективных также является эндоскопический метод реканализации (восстановления) просвета пищевода с использованием различных способов разрушения стенозирующей опухоли: электродеструкции, лазерной или аргоноплазменной коагуляции. Электрохирургическая высокочастотная коагуляция и резекция, позволяя восстановить в той или иной степени просвет пищевода у 83–98 % больных, является все же довольно опасной процедурой, осложняясь кровотечениями и перфорациями пищевода вследствие трансмурального некроза в 5–9 % случаев (Кувшинов Ю. П., Поддубный Б. К., Ефимов О. Н. и др.). Эндоскопическая хирургия опухолевых и послеоперационных стенозов у больных раком пищевода и желудка. // Современная онкология. - 2000. - т. 2, № 3. - с.72–78; Луцевич Э. В., Праздников Э. Н., Мешков В. М. и др. Сравнительная оценка эндоскопических методов реканализации опухолевых стриктур пищевода. // 5-й Моск. межд. конгр. по эндоскоп.хир./ Сб. тезисов. - М.- 2001. - с.109–110; MannouryY., BrunetaudJ.M. etat. Endoscopic palliation for inoperable malignant dysphagia: Long term Follouwup.// Endoscopy,- 1992. - 33. - p. 1602; Gouerou H. La reduction tumorale endoscopique par electrocoagulation monopolaire. // Gastro graph. - 1995. - № 19. - p.5–6).
Высокоэнергетическое лазерное излучение, основанное на принципе фотокоагуляции и испарения опухолевой ткани, обеспечивает эффективную реканализацию даже при распространенных опухолевых стенозах у 78–93 % больных (Kopacz A., Jastrzebski Т., Swierblewski М. etal. ZastosowanielaseratypuNd: YAGwpaliatywnymleczeniurakaprzelykuIwpustu. // Pol. prz. сhir. - 1996. - 68, № 10. - р.986-997; De Palma G.D., SiveroL., GalloroG. etal. La palliazione endoscopica della disfagia secondaria a recediva dell area anastomotica dopo resezione esofagea e gastrectomia totale per carcinoma. // Minerva chir. - 1998. - 53. - № 10. - р.781–785; Norberto L., Ranzato R., Erroi F. et al. La palliazione del carcinoma esofageo e cardiale. // Minerva chir. - 1999. - Vol.54, № 10. - p.647–655.). Однако эта методика также имеет свои недостатки: задымление, выраженный отек тканей в зоне действия теплового луча, трудность определения осевой линии пищевода при стенозе его просвета, невозможность контроля глубины термического ожога. Недооценка этих факторов может привести к серьезным осложнениям, наиболее грозное из которых — перфорация пищевода, встречающаяся в 2–6 % случаев (Mitty R. D., Cave D. R., Birkett D. H. One-stageretrogradeapproachtoNd: YAGlaserpalliationofesophagealcarcinoma.// Endoscopy. - 1996. - Vol.28, № 4. - p.350–355; Bisgaard Т., Wojdemann M., Heindorff H et al. Nonsurgical treatment of esophageal perforations after endoscopic palliation in advanced esophageal cancer. //Endoscopy. - 1997. - 29. - p.155–159).
В настоящее время все большее применение для девитализации (разрушения) опухолей пищевода получает новый способ коагуляции — аргоноплазменной коагуляции, в котором энергия ионизированного газа (аргона) передается на тканевые структуры бесконтактным способом. Сочетая в себе преимущества методов высокочастотной хирургии и Nd —YAG-лазера, метод аргоноплазменной коагуляции лишен их недостатков, позволяя в большинстве случаев восстанавливать просвет пищевода при отсутствии угрожающих для жизни пациентов осложнений (Сторек Д., Грунд К. Е., Шютц А. и др. Аргоноплазменная коагуляция в «гибкой» эндоскопии — замена лазеру?// Эндоскопия сегодня. - 1994. - № 2. - С.163–170; Грунд К. Е., Циндель К., Фарин Г. Практические указания по применению метода аргоноплазменной коагуляции (АРС) в «гибкой» эндоскопии. // Эндоскопия сегодня. - 1996. - № 4. - с.338–343; Грунд К. Е., Циндель К., Фарин Г. Применение метода аргоноплазменной коагуляции (АРС) в «гибкой» эндоскопии. // Немецкий еженедельный медицинский журнал. - 1997. - 122. - с.432–438).
Для обеспечения питания пациентов, у которых опухоль полностью закрывает просвет пищевода, возможно хирургическое выполнение обходных анастомозов или формирование гастростомы.
Гастростома — это специальная трубка, которая вшивается в желудок и выводится через кожу наружу. Через нее можно вводить пациенту жидкость и пищу.

Брахитерапия в ряде ситуаций может использоваться для лечения первичной или рецидивной опухоли пищевода. Брахитерапия — это контактная лучевая терапия — вид радиотерапии, когда источник излучения (Ra-226, Ir-192, I-125, Cs-137, Co-60) вводится внутрь пораженного органа. Преимущество метода заключается в возможности подведения максимальных доз лучевой терапии непосредственно на опухолевый очаг и в зону интереса при минимизации воздействия на критические органы и смежные ткани.
Для лечения рецидивного рака пищевода используется внутриполостная брахитерапия.
Внутриполостная брахитерапия (intracavitary) используется при локализации опухоли в органах имеющих полостное строение. В полость вводят специальные аппликаторы, в которые затем доставляется радиоактивный источник по заранее запланированной программе лечения. В настоящее время внутриполостная брахитерапия осуществляется с помощью современных медицинских технологий, что дает возможность грамотно рассчитать лечебную дозу, необходимую для борьбы с тем или иным видом злокачественного новообразования.
С помощью брахитерапии возможно подвести значительно большую очаговую дозу к опухоли, щадя окружающие ткани. Местный терапевтический эффект от брахитерапии рака пищевода наблюдается у 56–71 % больных (Шулепов А. В., Туркевич В. Г., Горзов П. П. Современная внутрипросветная брахитерапия рака пищевода. // Диагност, и лечение опухолей./ С.-Петербургский Гос. мед. ун-т. - СПб. - 1997. - с.61–68.; Okawa Т., Dokija Т., Nisbio M. etal. Multiinstitutionalrandomizedtrial of external radiotherapy with and without intraluminal brachitherapy for esophageal cancer in Japan. Japanese Society of Therapeutic Radiology and Oncology (JASTRO) Study Group // Int. J. Radiat. Oncol. Biol, Phys.- 1999.- Vol. 45, № 3. - p.623–628).
Иногда выраженный эффект при подведении суммарной очаговой дозы позволяет добиться стойкой длительной ремиссии. К сожалению, только половина больных раком пищевода может быть подвергнута внутриполостной лучевой терапии, что объясняется особенностями роста опухоли, часто приводящей к сужению, а нередко — и полной обструкции просвета пищевода, что делает невозможным доставку аппликатора (диаметром 6 мм) с радиоактивным источником к опухоли.
В ряде ситуаций для контроля за болезнью, особенно при наличии плоскоклеточного рака пищевода, используется дистанционная лучевая терапия.

Эффективность лучевой терапии при раке пищевода составляет 20–40 %.
Основным методом лечения диссеминированного рака пищевода остается системная химиотерапия. Помимо стандартных химиопрепаратов аденокарциномы пищеводно-желудочного перехода необходимо исследовать на гиперэкспрессию/амплификацию HER-2neu, так как при ее наличии добавление герцептина к стандартной химиотерапии улучшает отдаленные результаты.
Основные схемы химиотерапии, которые применяются при лечении диссеминированного рака пищевода
1. FP — фторурацил + цисплатин.
Фторурацил 1000 мг/м2 внутривенно, дни 1,2,3,4,5.
Цисплатин 100 мг/м2 , внутривенно, день 1.
Интервал между курсами 3–4 недели.
2. IP — иринотекан + цисплатин.
Иринотекан 65 мг/м2 внутривенно 1 раз в неделю в течение 4 недель.
Цисплатин 30 мг/м2 внутривенно 1 раз в неделю в течение 4 недель.
Циклы повторяют каждые 6 недель. Эффект 57 %.
3. РС — паклитаксел + цисплатин.
Паклитаксел 200 мг/м2 инфузия 24 часа, день 1.
Цисплатин 75 мг/м2 внутривенно, день 2.
Интервал между курсами 3 недели.
Существует несколько методов введения этого препарата.
1. Чаще всего гемзар вводится внутривенно капельно. Основная схема введения — это Гемцитабин 1 гр/м2 в/в , один раз в неделю в течение 3 или 7 недель. Проводится 2–3 курса с периодическим контролем эффективности лечения.
2. Гемзар может вводиться внутриартериально в артерию, питающую опухоль или метастазы в печени. Используются дозы как при внутривенном введении.
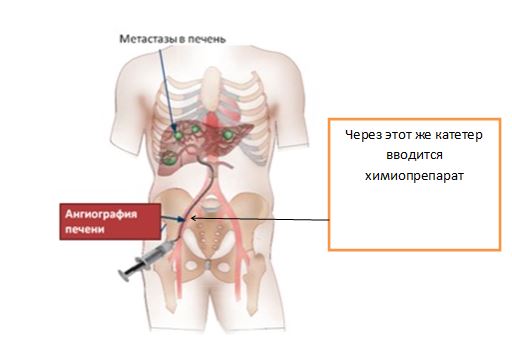
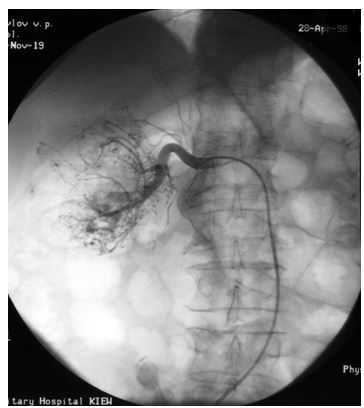
3. Гемзар может быть составным компонентом смеси, вводимой при химиоэмболизации. Применяется 1–1,5 грамма Гемзара в сочетании с липоидолом или другими компонентами.
Рентгенограмма химиоэмболизации метастазов в печень.
В лечении распространенного рака поджелудочной железы также могут использоваться следующие препараты и схемы.
XELOX — капецитабин + оксалиплатин:
капецитабин 100 мг/м2 два раза в день внутрь 1–14 дни;
оксалиплатин 130 мг/м2 внутривенно, день 1.
Интервал между курсами 1–2 недели.
Кроме химиотерапии или вместе с химиотерапией могут применяться другие методы местного разрушения опухоли и метастазов.
Hi-Fu — ультразвук высокой энергии.
Радиоактивные микросферы
химиоэмболизация микросферами, у которой носителем выступает HepaSphere (полимерная микросфера).
Высокочастотная абляция и другие.
 <
<
Microwaveablation, Микроволновая абляция — малоинвазивный метод для лечения метастазов печень.
Паллиативная и поддерживающая терапия
Паллиативная терапия является важной частью лечения, так как обеспечивает благоприятный фон, позволяющий вообще проводить какое- либо специальное лечение.
Желтуха является наиболее частым осложнением при опухолях головки поджелудочной железы (70–80 %). Для коррекции используется наружное или внутреннее желчеотведение и установка стента в желчный проток. Эндоскопическая установка стента наиболее предпочтительна, так как дает меньше осложнений, чем чрескожное дренирование, и более комфортна для пациента.
Иногда (13–15 % случаев) требуется профилактическое выполнение гастроэнтеростомии, если имеется угроза непроходимости в зоне опухоли.
При болевом синдроме чаще всего требуются трамадол или наркотические анальгетики. Морфин является препаратом выбора. Иногда выполняется чрескожная блокада чревного сплетения. Анальгетический эффект наблюдается в 50–90 % случаев и продолжается от 1 месяца до года. В ряде ситуаций возможно установить в эпидуральное пространство катетер и вводить в него местные анестетики. Это тоже может обеспечивать контроль над болью.














